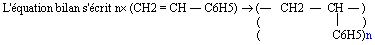Réactions sur les alcanes et les alcènes - polymères
1 Réactions sur les alcanes et les alcènes
1.1 La combustion des Alcanes
La combustion des alcanes est la réaction entre l'alcane et le dioxygène contenu dans l'air. La combustion dégage de la chaleur, c'est une réaction exothermique.
- Lorsque le dioxygène est en excès, la combustion est complète, le dioxyde de carbone et l'eau sont les seuls produits de la réaction
- Lorsqu'il est en défaut, la combustion est incomplète et les produits de la réaction sont du carbone et de l'eau et éventuellement du monoxyde de carbone.
- Pour savoir si le dioxygène est en défaut ou en excès, on se rapporte aux coefficients stœchiométriques.
Comment retrouver un hydrocarbure lorsque l'on connaît les produits de la réaction ?
- On sait qu'un hydrocarbure a une formule brute du type Cx Hy
- On ne retrouve du carbone que dans un seul produit (CO2 si la combustion est complète, C ou CO si elle est incomplète). Donc x= nombre de moles d'atomes de carbone présents dans les produits si une mole d'hydrocarbure est brûlée.
- Il faut donc exprimer la quantité de matière de chaque produit ou réactif connu (en général dans les problèmes on vous donne leur masse, il faut alors la diviser par la masse molaire des composés)
- Après avoir trouvé x, on détermine y Si l'énoncé précise que l'hydrocarbure est un alcane (ou un alcène) alors y=2x+2 (ou y=2x)
Sinon on compte la quantité de H dans les produits lorsqu'une mole d'hydrocarbure réagit et on équilibre pour trouver y.
1.2 Craquage et vapocraquage
Définitions :
- Craquer un alcane consiste à casser la molécule de cet alcane en molécules plus petites qui seront des alcènes ou des alcanes plus légers Cette réaction se fait à une température de 400°C
- Le vapocraquage est un processus identique au craquage mais il est réalisé en présence de vapeur d'eau.
- Buts de ces transformations: obtenir des alcanes légers essentiels pour la qualité des carburants Produire des alcènes nécessaires à l'industrie chimique
1.3 Réactions d'addition sur les alcènes
Principe de base : on casse la double liaison carbone pour y insérer de nouveaux constituants
1 - L'hydrogénation:
Elle permet d'obtenir à partir d'un alcène un alcane
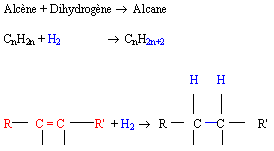
Le platine ou le nickel sont utilisés comme catalyseurs de cette réaction.
Pour le changement de nom faites attention au placement des groupes alkyles, sinon on a:
xxxxx-ène + dihydrogène -> xxxxx-ane
2 - L'halogénation
Elle permet d'obtenir des dibromoalcanes ou des dichloroalcanes suivant que l'on a ajouté du dibrome (Br2) ou du dichlore (Cl2)
- Alcène + dibrome -> dibromoalcane ; CnH2n + Br2 -> CnH2nBr2
- Alcène + dichlore -> dichloroalcane ; CnH2n + Cl2 -> CnH2nCl2
Dans les deux cas la réaction observée est une réaction d'halogénation d'équation bilan
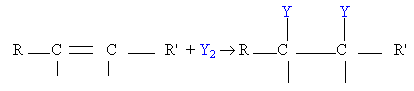
Avec Y=Br ou Cl
3 - L'hydratation
Elle permet d'obtenir un alcool en ajoutant un molécule d'eau à un alcène. Cette réaction ne peut cependant se produire qu 'avec de la vapeur d'eau à une température de 300°C et sous pression.
L'équation bilan de cette réaction est 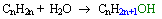
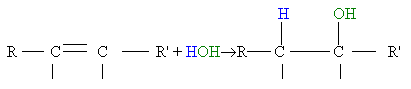
1.4 Test de reconnaissance des alcènes
Test au dibrome: tout alcène ou tout hydrocarbure insaturé (qui possède au moins une liaison double C = C) décolore une solution aqueuse de dibrome, initialement orange Explication: le dibrome se fixe sur l'alcène (halogénation)
Test au permanganate de potassium: la solution de permanganate de potassium passe du violet au vert en présence d'un alcène.
2 Composition massique d'un comosé
2.1 Définition
La composition massique d'un composé est la liste des pourcentages massiques des éléments qui le constituent
2.2 Méthode pour la calculer
- On calcule la masse dune mole du composé, par exemple l'éthène C2H4
M(C2H4) = 2 M( C ) + 4M(H) = 24+4 =28 g - On calcule la masse de chaque élément dans cette mole
Dans une mol d'éthène il y a 2 moles de carbone donc 24 g de carbone
4 moles d'hydrogène donc 4 g d'hydrogène - On calcule les proportions
- %C = 24/28 x 100 =85.71%
- %H = 4/28 x 100 ou bien on peut utiliser %C + %H =100 et %H= 100 - %C
- %H= 14.29%
2.3 Uutiliser la composition massique d'un composé pour déterminer la formule brute de ce composé
On va reprendre l'exemple précédent mais en sens inverse
Méthode :
- Repérer les éléments composant le composé : ici le carbone C et l'hydrogène H
- L'énoncé donne toujours la masse molaire du composé recherché, on multiplie la masse molaire par
les %massiques, on obtient alors la masse de chaque élément dans une mole du composé
- Ici m(C ) = M (C2H4) x %C = 24
- Et m(H) = 4
- On divise ces masses par la masse molaire des éléments et on obtient les quantités de ces
éléments présentes dans le composé
- n ( C) = m( C) / M( C) =24/12 = 2 mol
- n( H) = m(H) / M(H) = 4/1 =4mol
La formule brute du compose est donc C2H4
3 Polymères
3.1 La polyaddition
- Elle consiste en l'addition de molécules de grande taille identiques entre elles. Leur association forme une macromolécule qui est en fait la répétition d'un même motif un nombre fini de fois.
- Chaque fois que le motif est répété le degré de polymérisation du polymère augmente de1.
Le motif s'appelle le monomère.
L'assemblage de plusieurs motifs s'appelle un polymère.
3.2 Présentation de quelques polymères
- Le polyéthylène (P. E)
- Le monomère est l'éthylène CH2 = CH2
- L'équation bilan s'écrit n x ( CH2 = CH2) -> ( - CH2 - CH2 -)n
- Le polychlorure de vinyle (PVC)
- Le monomère est le chlorure de vinyle CH2 = CH - Cl
- Le monomère est le chlorure de vinyle CH2 = CH - Cl
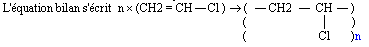
- Le polystyrène (P. S)
- Le monomère est le styrène CH2 = CH - C6H5