Le pH d'une solution acqueuse
1 L'acidité et sa mesure en solution acqueuse
1.1 L'échelle de pH
L’échelle de pH est comprise entre 0 et 14. Une solution dont le pH est compris entre 0 et 7 est acide, si le pH est entre 7 et 14, la solution est basique. Le pH 7 correspond à une solution neutre du point de vue acidobasique, ce qu’il ne faut pas confondre avec la neutralité électrique de la solution qui est vérifiée pour n’importe quelle solution.
1.2 Mesure du pH
Le pH se mesure avec un pH-mètre, du papier pH ou s’évalue grossièrement avec des indicateurs colorés comme le bleu de bromothymol.
2 Autoprotolyse de l'eau et définition du pH
2.1 Equation de la réaction d'autoprotolyse
L’eau se dissocie spontanément suivant la réaction réversible : 2H2O ß à H3O <-> OH-. Il s’agit de l’autoprotolyse de l’eau.
2.2 Définition du produit ionique de l'eau
Pour des solutions diluées (dont les concentrations ne dépassent pas 0, 1 mol.L-1), la quantité Ke = [H3O+].[OH-] est constante. Elle est appelée produit ionique de l’eau.
A 25 °C, Ke = 10-14.
Le fait de connaître la concentration en ions hydronium revient donc à connaître également celle en ions hydroxyde.
2.3 Définition du pH
Le pH est l’opposé du logarithme décimal de la concentration en ions H3O+ :
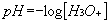
Dans le cas de l’eau pure à 25 °C, on retrouve :
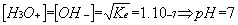
3 Acides forts et faibles - règles de sécurité
3.1 Solutions acides
A partir de l’étude de la dilution d’un acide, on distingue deux types de comportement :
Soit l’acide HA1 est complètement dissocié, l’acide est dit fort. C’est le cas de la solution de chlorure d’hydrogène HCl. La réaction suivante est totale :
HA1+H2O -> H3O++A1-
Soit l’acide n’est pas complètement dissocié, il s’agit d’un acide faible HA2. C’est le cas de l’acide éthanoïque. La réaction suivante est partielle :
HA2+H2O ß <-> H3O++A2-
3.2 Solutions basiques
Pour les solutions basiques, on distingue les bases fortes qui réagissent entièrement avec l’eau comme une solution de soude et les bases faibles qui réagissent partiellement avec l’eau comme l’ammoniac.
3.3 Règles de sécurité
Le contact des acides et des bases concentrés peut être très dangereux pour la peau et les yeux. Il est conseillé de manipuler ces produits en étant muni de gants, lunettes et blouse. Lors d’un prélèvement à l’aide d’une pipette, il est indispensable d’utiliser une pro-pipette ou poire à pipeter et il est fortement déconseillé d’aspirer du liquide avec la bouche.
En cas de projection d’acide ou de base dans les yeux, il faut rincer abondamment à l’eau et conduire la victime auprès d’un médecin.