La notion de nombre d'oxydation d'un élément
1 Définitions
Rappel : une liaison de covalence est la mise en commun par deux atomes d’une paire d’électrons
Lorsque l’un des atomes participant à la liaison attire davantage le doublet commun que l’autre, celui-ci ce déplace vers l’atome le plus attracteur et la partie de la molécule où il se situe admet alors une charge partielle négative notée - d. On dit alors de la liaison qu’elle est polarisée. La molécule reste globalement électriquement neutre mais certaines de ses liaisons sont polarisées.
On appelle électronégativité la tendance d’un atome à conserver les électrons par lesquels il se lie ou à attirer ceux qui lui sont communiqués par covalence.
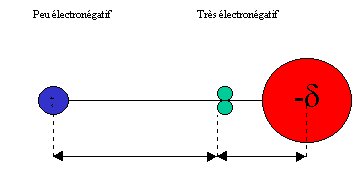
Un élément fortement électronégatif passe facilement à l’état d’anions tandis que les corps faiblement électronégatifs ont pour forme privilégiée celle des cations.
Cette électronégativité est traduite par une valeur comprise entre 0, 8 et 4, 0 qui permet de placer les éléments sur une échelle : l’échelle de Pauling .
2 La notion de nombre d'oxydation face à l'électronégativité
Pour préciser les réactions d'oxydoréduction, on associe à un élément chimique à l'état de corps simple ou d'ion monoatomique un nombre, noté en chiffres romains, appelé nombre d'oxydation à partir des conventions qui suivent :
- le nombre d'oxydation d'un élément à l'état de corps simple est nul.
- Plus généralement, le nombre d'oxydation d'un élément sous forme d'ion monoatomique est égal à la valeur algébrique de la charge de l'ion.
3 Règles de calcul sur les NO
- La somme algébrique de tous les nombres d'oxydation de tous les éléments présents dans un ion est égale à la charge de cet ion.
- La somme des nombres d'oxydation de tous les éléments présents dans une molécule est nulle. - Le nombre d'oxydation de l'hydrogène est (+ I)
- Le nombre d'oxydation de l'oxygène est généralement de (- II)
La somme algébrique des nombres d'oxydation de tous les éléments est nulle dans une molécule ou égale à la charge de l'ion pour un ion polyatomique.
4 Généralisation vers la notion d'oxydoréduction
Oxydation / Réduction
- Au cours d'une oxydation, le nombre d'oxydation de l'un des éléments composant le réactif et qui constitue l'espèce oxydée augmente.
- Au cours d'une réduction, le nombre d'oxydation de l'un des éléments constituant le réactif et qui constitue l'espèce réduite diminue.
Oxydant / Réducteur
- Un oxydant est une espèce chimique contenant un élément dont le nombre d'oxydation diminue lorsqu'il est réduit.
- Un réducteur est une espèce chimique contenant un élément dont le nombre d'oxydation augmente lorsqu'il est oxydé.
Réaction d'oxydoréduction
- Lors d'une réaction d'oxydoréduction, la diminution totale de nombre d'oxydation de l'espèce oxydante est égale à l'augmentation totale de nombre d'oxydation de l'espèce réductrice.
- Il y a une sorte de conservation du nombre d'oxydation total au cours de la réaction ; Le solde final doit être égal au solde initial.
5 Evolution des nombres d'oxydation au cours d'une réaction rédox
Il faut redécomposer les réactions d'oxydo-réduction en leurs deux demi-équations électroniques pour bien comprendre la méthode.
La réduction se traduit par une diminution du nombre d'oxydation de l'élément mis en jeu.
Par exemple :
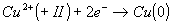
Dans ce cas le cuivre passe du nombre d'oxydation +II à 0. Il y a un
 n.o. de - II.
n.o. de - II.
L'oxydation se traduit par une augmentation du nombre d'oxydation de l'élément concerné. Ainsi,
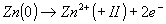
Ici, le zinc passe de (0) à (+II). Le
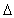 n.o. est de +II.
n.o. est de +II.
On constate que la somme des variations de nombres d'oxydation est bien nulle.
La somme des variations de nombres d'oxydation est toujours nulle dès lors que l'équation bilan de l'oxydo-réduction est bien équilibrée. Si la somme des variations en l'est pas, c'est qu'il y a une erreur dans l'équation bilan et que celle-ci ne traduit pas réellement la conservation des charges.
Par exemple : en prenant deux couples
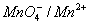 et
et
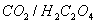 . On
c'est que l'oxydant
. On
c'est que l'oxydant 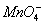 réagit avec le réducteur.
réagit avec le réducteur.
- Pour la réduction, on voit apparaître un
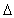 no de -V.
no de -V.
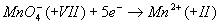
- Pour l'oxydation, on voit apparaître un
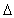 n.o.' de +II.
n.o.' de +II.
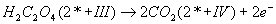
Si l'on additionnait les deux demi-équations, on obtiendrait, ce qui est manifestement faux ne serait ce qu'en vertu de la loi de conservation des charges.
Si l'on observe les nombres d'oxydations, on constate que pour qu'il y ait égalité, on doit prendre 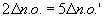
L'équation bilan devient alors :
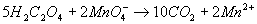
On doit alors équilibrer les charges au moyen des ions H+ fournis par la solution acide, la conservation des atomes d'oxygène et des noyaux d'hydrogène étant assurée par la production de molécules d'eau.
En milieu acide ou basique, la conservation des charges est respectivement permise par les ions H+ ou OH- et les atomes d'oxygène et les noyaux d'hydrogènes sont restitués sour forme de H2O.
6 Méthodologie
Méthodologie
Pour ne pas se tromper, il faut procéder avec méthode :
- faire un bilan des espèces en présence, réactifs et produits
- calculer le nombre d'oxydation dans les réactifs et dans les produits.
- observer les variations du nombre d'oxydation de chacun d'eux
- ajuster les coefficients stœchiométriques pour que la somme de toutes les variations soit nulle ( aucun électron n'apparaît ni ne disparaît, aucun 'point' de nombre d'oxydation n'apparaît ni ne disparaît.
Les difficultés de la leçon :
Il faut connaître
- les règles de calcul sur les nombres d'oxydation
- maîtriser parfaitement les concepts d'oxydant, réducteur, oxydation et réduction.
Il faut faire très attention :
- lors de l'application des coefficients stœchiométriques pour assurer une conservation des nombres d'oxydations.
- aux signes des nombres d'oxydation sur lesquels on travaille. Il ne faut surtout pas omettre de les prendre en considération dans les calculs.