Molécules et réactions chimiques
1 Les molécules
1.1 Notion de molécule
- Une molécule est une entité formée d'atomes.
- Cette entité est électriquement neutre !
- Un ion n'est jamais une molécule, de même une molécule ne porte jamais de charge!
- Le nombre d'atomes dans une molécule est l'atomicité de cette molécule.
Exemple : H2O est une entité électriquement neutre formée de 2 atomes d'hydrogène et d'un atome d'oxygène, c'est donc une molécule d'atomicité 3.
1.2 Formule brute d'une molécule
Chaque molécule possède un nom et une formule ("formule brute") qui lui sont propres.
La formule brute s'écrit en représentant les symboles des atomes présents avec en indice le nombre de fois où ils sont présents.
Exemples : CO2, NH4, C2H6 ! on n'écrit jamais l'indice 1, on n'écrit pas C1O2 mais CO2!
2 Liaison covalente
2.1 Définition
La valence : la valence d'un atome est le nombre d'électrons célibataires qu'il comporte (d'où le nom couche de valence).
Nomenclature:
- Un atome de valence 1 (les alcalins par exemple) est dit monovalent
- Un atome de valence 2 est dit bivalent (le Magnésium)
- Un atome de valence 3 est dit trivalent (le Bore)
- Un atome de valence 4est dit tétravalent (le Carbone)
Liaison covalente : c'est ce qui permet aux atomes de "s'associer" pour former des molécules.
- Liaison covalente simple : c'est lorsque 2 atomes mettent en commun deux
électrons célibataires (un par atome), on dit que ces 2 atomes mettent en commun un doublet
d'électrons, sur la représentation de Lewis la liaison covalente simple est représentée par
un trait
- Exemple: la molécule de dihydrogène H2 :
- Liaison covalente double: dans ce cas, ce sont 2 doublets d'électrons qui sont mis en commun, on représente la liaison covalente double par le symbole
- Liaison covalente triple: 3 doublets d'électrons sont mis en commun
2.2 Conséquences
Toute liaison covalente créée une molécule électriquement neutre.
Le plus souvent en formant des liaisons de covalence l'atome acquiert une structure en octet (8 électrons sur sa couche externe)
2.3 La règle de l'octet appliquée aux molécules
Les liaisons de covalence se réalisent de manière à ce que les atomes liés acquièrent la structure en octet, extrêmement stable chimiquement.
Exemple d'application: Grâce à cette règle, nous pouvons justifier la structure d'une molécule.
Prenons le cas de l'ammoniac NH4 N a pour nombre atomique Z = 7, sa formule électronique est donc (K)2(L)5, il possède donc 5 électrons de libres sur sa couche externe.
Pour acquérir la structure en octet il lui faut donc lier 3 liaisons covalentes, l'atome d'azote est trivalent. Or l'atome d'hydrogène est monovalent s'il forme une liaison de covalence simple il acquiert alors la structure de l'hélium (seul gaz rare dont la structure n'est pas en octet) Donc l'atome d'azote et chaque atome d'hydrogène mettent un doublet d'électrons en commun.
La représentation de Lewis de la molécule d'ammoniac est alors :
3 La réaction chimique
3.1 Quantité de matière et masse molaire
La mole : elle correspond à une quantité de matière. Par convention à une mole correspond 6.023´1023 atomes (environ six cent mille milliards de milliards!) Comme la masse d'un atome est extrêmement petite, on préfère utiliser un grandeur plus à notre échelle, on utilise donc la mole.
La constante d'Avogadro (chimiste italien) : Elle se note NA et vaut 6.023 x 10E23 mol-1
On a alors n = N / NA avec :
- N : le nombre d'atomes d'ions ou de molécules du système
- n : la quantité de matière du système ( en mol)
La masse molaire atomique d'un élément : c'est la masse d'une mole d'atomes de cet élément. Elle est indiquée dans la classification périodique en haut à droite de l'élément (l'unité donnée dans le tableau est le g.mol-1).
Ordre de grandeur: pour les éléments, celui qui possède la masse molaire la plus forte est le Lawrencium (257g.mol-1), l'hydrogène ne pèse lui que 1g.mol-1.
!! On remarque qu'avec cette unité (le gramme par mole) la masse molaire d'un atome " son nombre de masse A " le nombre de nucléons de l'atome!!
La masse molaire moléculaire: C'est la masse d'une mole de cette molécule Pour la
calculer on utilise la masse molaire atomique des atomes qui la composent.
Exemple: M(H20) = 2M(H) + M(O) = 2 x 1 + 16 = 18g.mol-1
La masse molaire d'un composé ionique : on ne tient pas compte de la charge, on
calcule comme si ce composé était électriquement neutre
Exemple : l'ion calcium Ca2+ a pour masse molaire M(Ca) = 40.1g.mol-1
3.2 Conventions d'écriture
- Le symbole d'un élément représente une mole d'atomes de cet élément.
- Le symbole d'un corps représente une mole d'atomes de ce corps
Tableau récapitulatif
| Masse | m | le gramme, g |
| Masse Molaire | M | le gramme par mole, g.mol-1 |
| Quantité de Matière | n | la mole, mol |
| Grandeur | Notation | Unité |
Comment trouver les relations ?
| La masse m de l'échantillon | La quantité de matière n | n = m/M |
| La quantité de matière de l'échantillon | La massse m | m = n x M |
| Données | Recherche | Formule |
3.3 Le volume molaire des gaz
La loi d'Avogadro ampère
Pris dans les mêmes conditions de température et de pression, des volumes égaux de gaz différents
- Contiennent le même nombre N de molécules
- Donc la même quantité n de matière
| 0°C | 1.013 bar | Vm = 22.4L.mol-1 |
| 20°C | 1.000 bar | Vm = 24L.mol-1 |
| Température | Pression | Volume molaire |
La valeur du volume molaire dépend uniquement des conditions de température et de pression.
Relations entre volume, quantité de matière et volume molaire d'un gaz
- V = n x Vm
- n= V / Vm
- Vm= V / n
4 Bilan de la réaction chimique
Principe essentiel : la conservation des éléments
Si les réactifs d'un mélange réactionnel
- Sont dans les proportions stœchiométriques (cf. cours précédent), alors au cours de la réaction tous les réactifs vont être utilisés
- Ne sont pas dans les proportions stœchiométriques alors seul le réactif en défaut va être totalement consommé au cours de la réaction. Dans le mélange final on va trouver les produits de la réaction et les réactifs en excès.
Méthode
Soit la réaction 4 NH3 +5 O2 -> 4 NO +6 H2O
Pour que le mélange initial soit dans des proportions stœchiométriques, il faut que :
5xn(NH3) = 4xn(O2) soit n(NH3)/4 = n(O2)/5)
On établit alors le tableau du Bilan Molaire
| Réactif | NH3 | no (NH3) | no(NH3) - 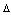 (NH3) (NH3) |
| O2 | no(O2) | no(NH3) - 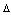 (O2) (O2) |
|
| Produits | NO | 0 | 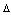 (NO) (NO) |
| H2O | 0 | 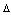 (H2O) (H2O) |
|
| Quantités initiales | Quantités finales | ||
On utilise alors les proportions
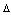 (NH3) / 4 =
(NH3) / 4 =
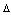 (O2) / 5 =
(O2) / 5 =
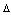 (NO) / 4 =
(NO) / 4 =
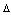 (H2O) / 6
(H2O) / 6
Si un réactif est en excès ces calculs nous permettront de déterminer quelle quantité de ce réactif a été consommé.