Carbone - alcanes - alcènes
1 Le carbone
A l'état solide le Carbone peut se présenter sous 2 formes, le diamant (les atomes de carbone sont alors tétragonaux), le graphite (où ils sont trigonaux).
1.1 Mise en évidence de l'élément carbone
Il existe deux manières de le mettre en évidence : la combustion et la pyrolyse, comparons les :
- Lors de la combustion on met le composé au contact direct de la flamme, sous l'action du dioxygène présent
dans l'air le composé s'oxyde, donc de la chaleur se dégage.
- Si la combustion est complète : Composé en
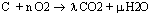
- Si elle est incomplète, il reste alors du carbone dans les produits NB on identifie le CO2 aisément car il trouble l'eau de chaux.
- Si la combustion est complète : Composé en
- Lors de la pyrolyse, le composé n'est pas mis en contact direct avec la flamme (il est protégé par des parois dans le cas des fours à pyrolyse), il y a donc un unique réactif : le composé lui même qui se décompose sous l'action de la chaleur. NB il se forme alors un résidu noir, le carbone pur
1.2 Propriété essentielle du carbone
Il est tétravalent, c'est à dire qu'il peut lier 4 liaisons de covalence.
Qu'est-ce qu'un hydrocarbure? C'est un corps composé uniquement de Carbone et d'Hydrogène, leur formule brute est donc du type CxHy, avec x et y des entiers naturels.
2 Les alcanes
2.1 Propriétés
- Les alcanes sont des hydrocarbures
- Leur formule brute est du type CnH2n+2
- Dans leur formule développée les liaisons entre les atomes de carbone sont toujours simples
- Autour de ces liaisons simples C - C la rotation des atomes est libre
Exemple : l'éthane, C2H6
- Formule brute
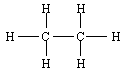
- Formule semi-développée : H3C --- CH3
- Qu'entend-on par chaîne linéaire? C'est le cas où tous les atomes de carbone sont sur la même ligne, dans la formule brute de l'éthane il y a une chaîne linéaire.
- Qu'entend-on par chaîne ramifiée? C'est lorsque tous les atomes de carbone ne sont pas représentés sur la même ligne dans la formule développée.
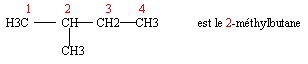
Exemple: le méthylpropane
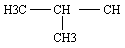
2.2 La nomenclature
Un composé se terminant par -ane, est un alcane.
Cependant pour la nomenclature on opère en trois temps:
-
Les alcanes dont la chaîne carbonée est linéaire
Pour les 4 premiers alcanes il n'y a pas de règle expliquant leur nom, il faut les apprendre par cœur
Méthane CH4 ; Ethane C2H6 ; Propane C3H8 ; butane C4H10
Pour les suivants, on utilise le préfixe grec correspondant au nombre d'atomes de carbone de l'alcane.- Pent = 5
- Hex = 6
- Hept = 7
- Oct = 8
- Les groupes alkyle (qui ne sont pas réellement des alcanes)
On obtient un groupe alkyle en ôtant un atome d'hydrogène à un atome de carbone terminal
Exemples :- CH3 est nommé le méthyle
- C2H5 est l'éthyle
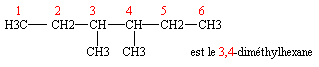
- Les alcanes à chaîne carbonée ramifiée
Méthode à suivre absolument
- Repérer la chaîne carbonée la plus longue
- c'est la chaîne principale, c'est elle qui fournit son nom à l'alcane
- Numéroter les atomes de carbone de cette chaîne Ø Autour de cette chaîne se trouvent des groupes alkyle, nommez-les
- Il faut adopter la numérotation des atomes de carbone qui relie les groupes alkyles aux atomes de carbone avec les plus petits numéros possibles
- Le nom du composé est alors le nom de l'alkyle (précédé du préfixe bi- ou tri- si il y a lieu) suivi du nom de l'alcane
- Sont dits isomères de constitution deux molécules qui ont :
- La même formule brute
- Une formule développée différente
3 Les alcènes
3.1 Propriétés
- Les alcènes sont des hydrocarbures
- Leur formule brute est du type CnH2n
- Il y a au moins une double liaison
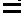 entre deux atomes de carbone, ce sont donc des hydrocarbures insaturés
entre deux atomes de carbone, ce sont donc des hydrocarbures insaturés - Il n'y a pas de rotation possible autour des doubles liaisons
3.2 Nomenclature
Un composé se terminant par -ène est un alcène
La nomenclature est proche de celle des alcanes, il faut toujours repérer la chaîne
carbonée principale (celle qui passe par la double liaison C 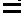 C)
C)
Apprenez cet exemple par cœur pour bien comprendre (en général les alcènes que vous aurez à rencontrer seront moins difficiles à nommer)
Exemple : soit l'alcène de formule semi-développée
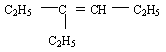
Sa formule brute est alors
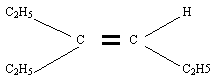
- La chaîne carbonée la plus longue est alors
- Elle possède 6 atomes de carbone et caractérise donc l'hex-ène
- On numérote alors les atomes de carbone de la chaîne (!attention les atomes pas les molécules, ainsi C2H5 aura les numéros 1 et 2!)
- On adopte la numérotation qui donne le plus petit numéro à la double liaison, ici
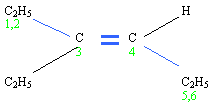
- Le premier atome de carbone de la double liaison porte le numéro 3, on a donc de: L'hex-3-ène
- Enfin on voit que relié à l'atome de carbone numéro 3 il y a un groupe alkyle: l'éthyle
- Le nom du composé est donc le 3-éthylhex-3-ène
4 Isomérie
4.1 Définition générale
- Deux isomères ont des formules brutes identiques, mais des formules développées différentes
- Deux isomères possèdent des propriétés chimiques et physiques différentes
4.2 Comment trouver des isomères
Cas spécifique des alcènes: la stéréo-isomérie Z, E. Il faut que l'alcène ait une formule brute du type 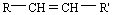
Avec R et R' deux composés
On a alors :
- L'isomère Z (de l'allemand zusammen : ensemble), de formule développée:
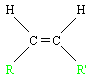
- L'isomère E (de l'allemand entgegen : opposés), de formule développée :
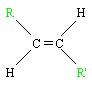
Méthode pour les isoméries "de constitution"
- Tenter toutes les constructions possibles avec la chaîne carbonée, ne pas oublier les formes en pyramide.
- Faire varier le nombre.